The Golgi apparatus as calcium stores
-
摘要:
回顾学科在高尔基器钙库钙研究方面所作出的贡献,以及该领域的近期概况.重点阐述高尔基器钙库概念的提出,以及目前已知的高尔基器钙库相关功能蛋白如SPCA1/2、GAAP的结构与功能.
-
关键词:
- 高尔基器 /
- 钙库 /
- 分泌通路钙泵(SPCA) /
- 高尔基抗凋亡蛋白(GAAP)
Abstract:At the point of the 100 years’ foundation of the discipline of biology at Beijing Normal University, this brief review presents the early contribution of researchers at BNU towards the conception of Golgi apparatus as distinct calcium stores. The current field is outlined, with description of major functional proteins such as secretory pathway calcium pumps (SPCA), and calcium-releasing channel of Golgi anti-apoptotic protein (GAAP).
-
0 引言
北京师范大学生命科学学院原细胞生物学研究所薛绍白教授领衔的研究小组,于1994、1995年在《Cell Research》发表2篇论文,揭示高尔基器(Golgi apparatus)的胞内Ca2+库功能[1−2].2篇论文对于高尔基器Ca2+库的阐述,属于在高尔基器Ca2+库研究领域的早期工作,具有明显的原创性.
高尔基器是蛋白质转运和细胞分泌通路上的重要中转站,在分泌细胞如胰腺腺泡细胞尤其发达.高尔基器与内质网(endoplasmic reticulum, ER)、线粒体、溶酶体、分泌囊泡等一起,共同构成细胞的胞内钙库.本文梳理自1994年以来,高尔基器Ca2+库研究的主要进展,重点展示高尔基器Ca2+库钙稳态相关的几种功能蛋白质.
1 高尔基器钙库:早期形态学证据及腔面游离Ca2+浓度检测
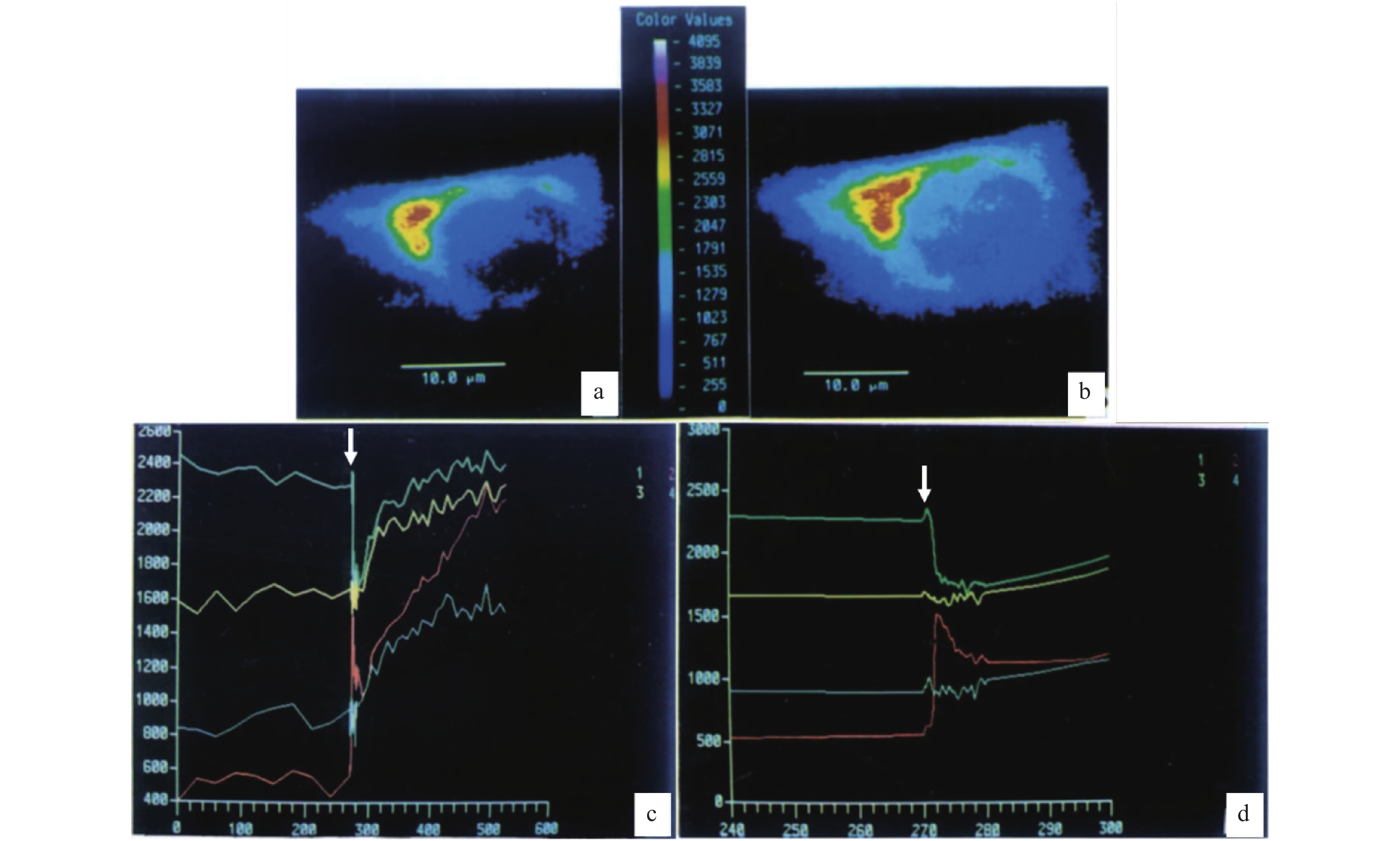
薛绍白教授研究小组,将成纤维细胞NIH3T3在玻璃盖玻片上培养,爬片后的细胞加载胞浆Ca2+指示探针Fluo-3 (Fluo-3 AM, 10 µmol·L−1, 30 min),以及高尔基器指示剂C6-NBD-神经酰胺 (10 min).研究发现在Fluo-3荧光共聚焦成像时所显示的胞浆高钙区域,集中于核周区域;之后加载高尔基器指示剂C6-NBD-神经酰胺 (10 min),因为C6-NBD-神经酰胺的荧光亮度远大于Fluo-3,将相机(charge-coupled device, CCD)增益降低至只显示C6-NBD-神经酰胺的荧光,发现高尔基器指示剂的荧光亚细胞分布与Fluo-3高度重叠 [1].这一共定位的现象,随细胞周期的运转而呈现或消失.在细胞有丝分裂中期高尔基器消失,Fluo-3显示的高钙区域消失;在细胞有丝分裂间期,高尔基器重新出现,Fluo-3显示的高钙区域重新出现[1].同时将加载了Fluo-3的间期NIH3T3细胞的质膜使用毛地黄皂苷(digitonin)在无钙缓冲液中予以通透,细胞质膜通透后,Fluo-3荧光幅值的降低,与在非高尔基器区域的大幅度降低相比,在高尔基器区域的降低要小很多(相差40%).说明Fluo-3荧光所展示的高钙浓度,归属于高尔基器腔面[1].
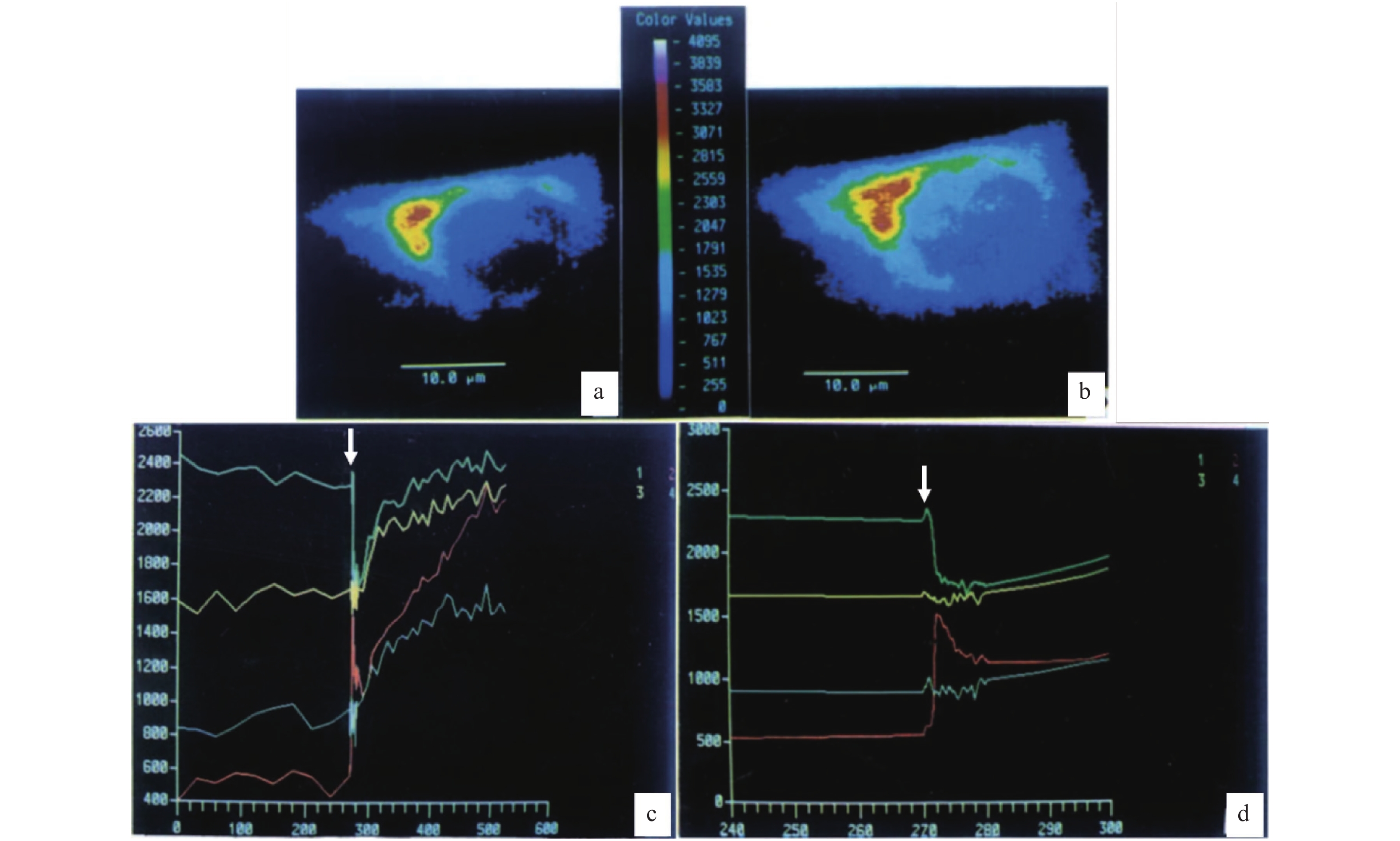
随后研究发现,将人胚胎肺成纤维细胞系2BS在玻璃盖玻片上培养,加载Fluo-3 (10 µmol·L−1, 60 min),Fluo-3荧光共聚焦成像后将成像增益调低至检测不到Fluo-3荧光;这时加载高尔基器探针C6-NBD-神经酰胺 (10 min),共聚焦显微成像后,得到高尔基器的亚细胞分布图.实验结果显示,Fluo-3荧光亚细胞分布与C6-NBD-神经酰胺荧光的亚细胞分布高度重叠(图1-a、b).使用血小板衍生的生长因子(platelet-derived growth factor, PDGF, 5 µg·mL−1)刺激处于无钙胞外液的2BS人胚胎肺成纤维细胞,再刺激早期的同一个细胞,可以显示高尔基器腔面Ca2+浓度的快速降低,以及细胞核Ca2+浓度的同步迅速升高(图1-c、d),说明高尔基器钙库所释放的Ca2+被细胞核所摄取.之后高尔基器、细胞核、胞浆Ca2+浓度持续升高[2].PDGF刺激之后的晚期Ca2+浓度升高,应该是ER钙库的钙释放,导致细胞浆、细胞核钙升高,以及高尔基器钙库的钙重摄取.将ER钙库抑制剂毒胡萝卜素内酯(thapsigargin, Tg, 200 ng·mL−1)与加载了Fluo-3的2BS细胞共孵育,发现Ca2+浓度升高的顺序是高尔基器区域、细胞核、细胞浆[2].
![]() 图 1 高尔基器钙库的早期形态学证据[2]游离钙离子与高尔基器在2BS细胞的亚细胞共定位,说明核周高钙区域与高尔基器区域重合。a. 一个2BS细胞的Fluo-3荧光亚细胞分布;b. C6-NBD-神经酰胺在同一个2BS细胞的亚细胞荧光分布.注意a、b图中荧光亚细胞分布的相似性.c. PDGF刺激一个加载了Fluo-3荧光探针的2BS细胞,细胞不同区域的Fluo-3荧光强度随时间的变化.绿、红、黄、蓝色曲线分别代表在同一个2BS细胞中,高尔基器、细胞核以及选定的2处不同的胞浆区域的钙离子浓度变化,白色箭头显示PDGF刺激的开始.d. 是c的时间轴扩展放大,注意高尔基器钙离子浓度(绿色)降低的同时,细胞核钙离子浓度(红色)反向升高.
图 1 高尔基器钙库的早期形态学证据[2]游离钙离子与高尔基器在2BS细胞的亚细胞共定位,说明核周高钙区域与高尔基器区域重合。a. 一个2BS细胞的Fluo-3荧光亚细胞分布;b. C6-NBD-神经酰胺在同一个2BS细胞的亚细胞荧光分布.注意a、b图中荧光亚细胞分布的相似性.c. PDGF刺激一个加载了Fluo-3荧光探针的2BS细胞,细胞不同区域的Fluo-3荧光强度随时间的变化.绿、红、黄、蓝色曲线分别代表在同一个2BS细胞中,高尔基器、细胞核以及选定的2处不同的胞浆区域的钙离子浓度变化,白色箭头显示PDGF刺激的开始.d. 是c的时间轴扩展放大,注意高尔基器钙离子浓度(绿色)降低的同时,细胞核钙离子浓度(红色)反向升高.上述在小鼠胚胎成纤维细胞NIH3T3、人胚胎肺成纤维细胞2BS,以及C3H小鼠胚胎成纤维细胞C3H10T1/2的共聚焦荧光成像等结果[1−2],为高尔基器钙库的存在,提供了非常重要的形态和功能学证据.
在成纤维细胞开展的并明确提出高尔基器钙库的研究工作[1−2],与在猪肾近端小管上皮细胞使用其他方法所开展的提出高尔基器钙库概念的类似工作[3]相比,属于同期或者稍早一些.
Zha等[3]发现,在肾脏近端小管上皮细胞LLC-PK1,高尔基器被布雷菲德菌素A (brefeldin A, BFA)处理破坏后,精氨酸血管加压素刺激所引发(Ca2+荧光探针Calcium Green所显示的)胞浆Ca2+浓度升高,大幅降低;将细胞样本冷冻处理后的亚细胞离子总量显微术显示,核周高尔基器区域的总钙含量在精氨酸血管加压素处理1 min后(精氨酸加压素刺激后将细胞迅速冷冻干燥)显著降低,布雷菲德菌素A处理也导致核周高尔基器总钙含量降低,因而提出高尔基器钙库的概念.
1995年后所报道的关于高尔基器钙库的更为系统和深入的工作[4−6],与1995年的2项工作相比,要晚4~5年.这些工作包括将水母发光蛋白(aequorin)在HeLa细胞的高尔基器定位表达后(ST-HA1-GoAEQmutAsp119Ala),发现组织胺刺激导致高尔基器腔面钙浓度的迅速、显著降低 [4].将高尔基器腔面钙螯合蛋白CALNUC在HeLa细胞过表达,发现高尔基器钙库容量大幅增加(放射性的45Ca2+摄取大幅增加) [6].以及在酵母细胞,高尔基器钙库存在的实验证据[5].
北京师范大学研究小组当时所使用的荧光探针Fluo-3,与Ca2+结合的亲和力较高,其解离常数Kd值为390 nmol·L−1 (https://www.aatbio.com/catalog/calcium-indicators#Fluo3andFluo4, 2023-05-04).按照荧光指示剂有效指示范围为Kd的0.1~10.0倍的标准,其最为有效的Ca2+浓度探测范围,为39.0 nmol·L−1~3.9 µmol·L−1.所谓的胞浆钙探针,加载细胞之后,也在细胞器中分布.但因为其Kd范围只适合检测胞浆钙浓度- 静息浓度约100 nmol·L−1,刺激后 ≥ 1 µmol·L−1.欲更加有效地检测钙库钙浓度,钙库专用探针的钙亲和力应更低,也就是Kd值需要更大.欲更加深入细致地研究高尔基器钙库中的游离Ca2+浓度的变化规律,显然需要亲和力更低(Kd值更高)的钙库专用钙探针.这些钙库特异性的Ca2+荧光探针,包括化学合成的荧光探针和基因编码的荧光蛋白质Ca2+探针,在之后陆续出现.
将低亲和力的、基因编码的红色荧光蛋白质Ca2+探针LAR-GECO1 (Kd = 24 µmol·L−1) [7] 在HEK293细胞的ER或高尔基器腔面表达,并将细胞加载胞浆荧光探针Fluo-8 (Kd = 389 nmol·L−1, https://www.aatbio.com/catalog/calcium-indicators#Fluo3andFluo4,2023-05-04)后,就可以同时检测细胞胞内钙库腔面和胞浆游离钙浓度的变化.将LAR-GECO1在HEK293细胞表达,并加载Fluo-8,乙酰胆碱受体激动剂卡巴胆碱(或称氯化氨甲酰胆碱, carbachol, CCh)和之后的甲状旁腺激素(parathyroid hormone, PTH),均刺激胞浆Ca2+浓度的增加,以及ER钙库和高尔基器钙库腔面游离Ca2+浓度的降低[8].事实证明,PTH刺激后所产生的胞浆游离cAMP,可以募集一个ER钙库的特定区域,使其在卡巴胆碱和甲状旁腺激素共同刺激时发挥作用,刺激ER钙库的钙释放[8].
高尔基器在脂肪和蛋白质翻译后的修饰和分拣中发挥重要作用.高尔基器在形态上有明显区别,包括堆积在一起的扁平囊(顺式和中间高尔基器、小管网状网络和独立囊泡、反式高尔基器) [9].形态学的不同,对应的是因不同亚区酶的差异性分布,从而产生功能上的差异[9].
将基因编码的荧光蛋白Ca2+指示剂(cameleon D1cpv)的N-端加上高尔基器驻在酶1,6 N-乙酰氨基葡萄糖转移酶的N-端32 个残基后,在高尔基器靶向表达.研究发现:中间高尔基器的钙摄取,使用肌浆ER钙泵和分泌通路钙泵;三磷酸肌醇(inositol trisphosphate, IP3)或雷诺丁(ryanodine)受体的激活介导其钙释放;腔面的钙浓度高于反式高尔基器腔面钙浓度,但是低于ER钙浓度[10].这些结果说明高尔基器钙库尽管存在细胞膜和内容物的持续流动,但每一个亚区可以维持其各自的特定钙稳态特性[10].
通过亚细胞特异性的基因编码的荧光蛋白质Ca2+指示探针,可以测量得到准确的钙库腔面游离Ca2+浓度.高尔基器腔面高钙浓度,是蛋白质处理分拣所必需的.高尔基器同时具备摄取和释放Ca2+的功能.将Ca2+指示探针水母蛋白在顺式、中间、反式高尔基器表达,可用于检测腔面Ca2+浓度.这种方法可以检测并比较ER和高尔基器钙库的Ca2+浓度甚至其钙库大小.实验发现在顺式高尔基器,腔面Ca2+浓度较高,可达150~300 μmol·L−1,主要是肌浆网/内质网钙库(SERCA)将胞浆Ca2+泵入高尔基器腔面[11].反式高尔基器可进一步分为远端反式高尔基器(tGo1)和近端反式高尔基器(tGo2) 2个区域.tGo1占比为20%,腔面Ca2+浓度高,主要通过分泌通路钙泵(secretory pathway Ca2+-ATPase 1, SPCA-1)的作用,将胞浆Ca2+泵入高尔基器,此处的钙泵对Ca2+亲和力较高 (K50 = 30 nmol·L−1);tGo2占比为80%,腔面钙浓度较低,无SPCA-1活性,钙摄取通过SERCA进行.tGo1和tGo2之间不能通过扩散交换物质[11].IP3可以刺激顺式高尔基器 (cGo)和tGo2释放Ca2+,但是不能从tGo1钙库动员释放Ca2+[11].咖啡因(caffeine)可以从所有高尔基器分区释放Ca2+,但是NAADP (nicotinic acid dinucleotide phosphate)和cADPR (cADP ribose)没有钙释放作用[11].
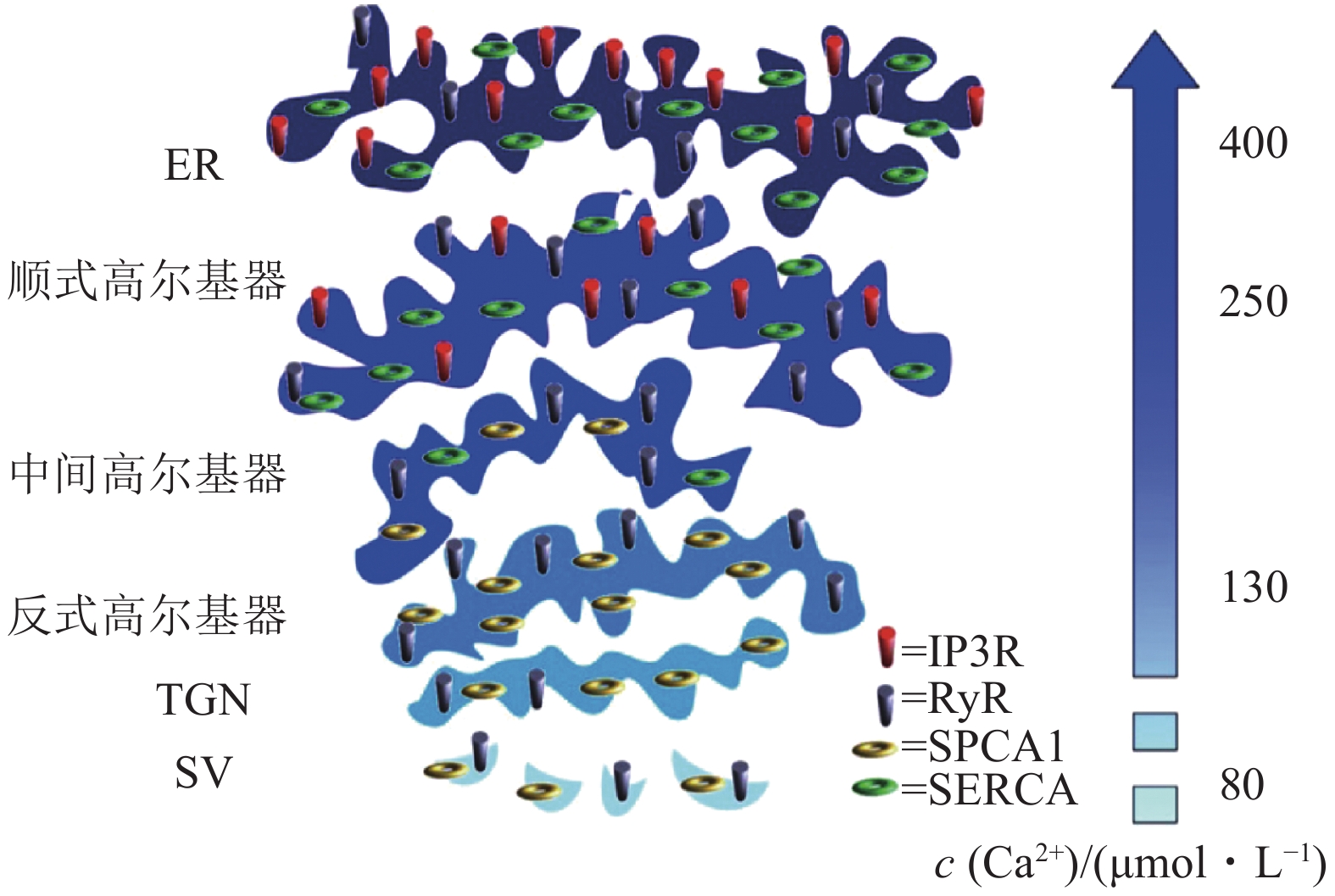
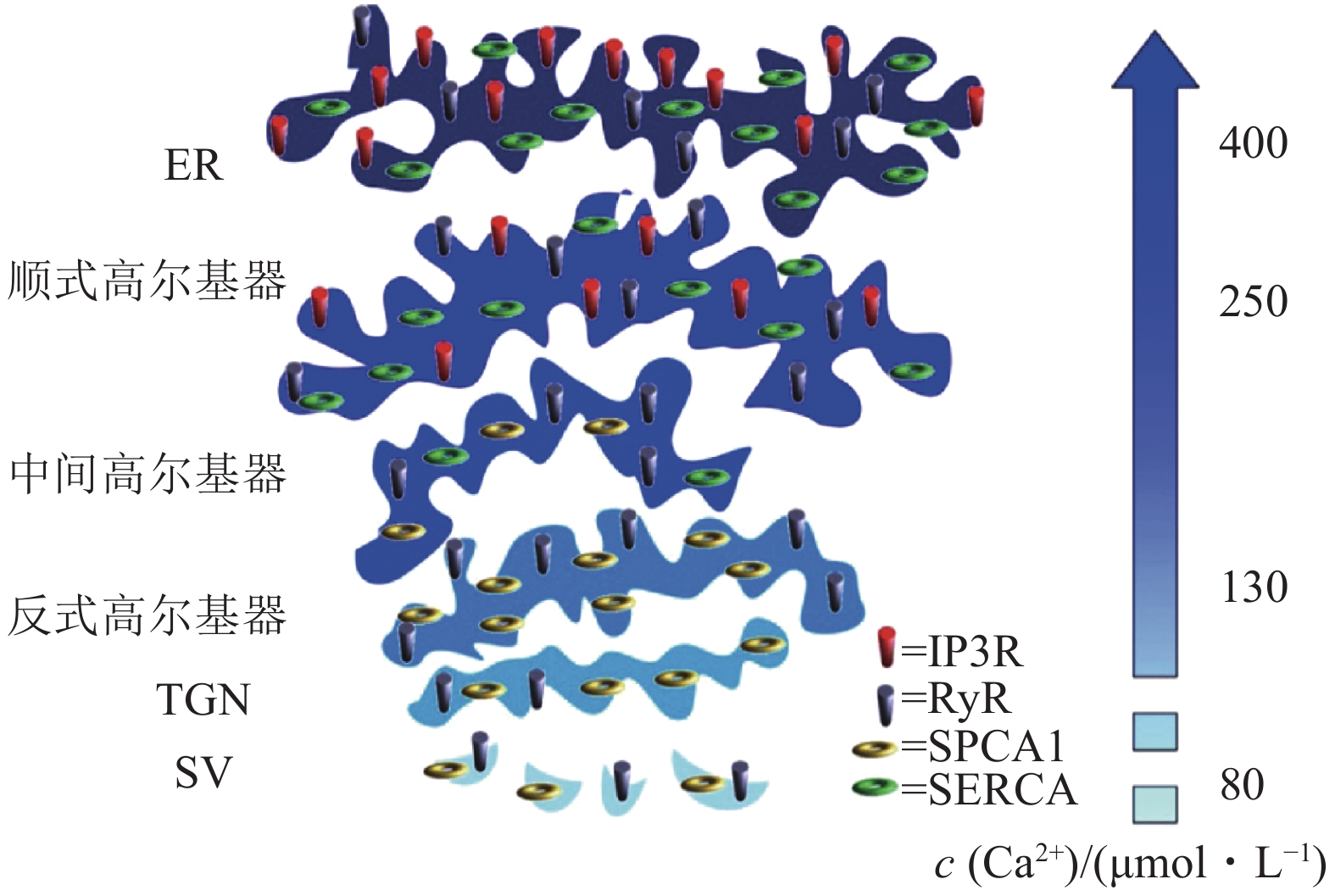
从一系列的系统研究可以发现,钙库Ca2+浓度从细胞核膜以及ER开始,呈梯度逐渐降低.如图2所示,ER钙库之中游离Ca2+浓度可达500 μmol·L−1,高尔基器从顺式(250 μmol·L−1)、中间(190 μmol·L−1)到反式高尔基器(130 μmol·L−1),其Ca2+浓度逐渐降低[9].分泌囊泡腔面的Ca2+浓度约为80 μmol·L−1 [9].
![]() 图 2 胞内钙库腔面Ca2+浓度的梯度分布[9]ER和高尔基器钙库腔面实测Ca2+浓度来自HeLa细胞,分泌囊泡腔面钙浓度数据来自胰岛素分泌细胞.不同钙库之中,钙稳态相关功能蛋白质的分布不同.ER表达有SERCA、IP3R、RyR,腔面Ca2+浓度平均约为400 μmol·L−1.高尔基器钙库分3部分:顺式高尔基器钙离子浓度平均约为250 μmol·L−1,表达SERCA、IP3R;中间高尔基器表达SERCA、 SPCA1,不表达IP3R;反式高尔基器表达SPCA1、RyR,但是不表达IP3R,腔面Ca2+浓度约为130 μmol·L−1.分泌囊泡(SV)包被膜表达SPCA1、RyR,腔面Ca2+浓度约为80 μmol·L−1.图中IP3R为 三磷酸肌醇受体;RyR为利阿诺定受体;TGN为反式高尔基器网络;SV为分泌囊泡.
图 2 胞内钙库腔面Ca2+浓度的梯度分布[9]ER和高尔基器钙库腔面实测Ca2+浓度来自HeLa细胞,分泌囊泡腔面钙浓度数据来自胰岛素分泌细胞.不同钙库之中,钙稳态相关功能蛋白质的分布不同.ER表达有SERCA、IP3R、RyR,腔面Ca2+浓度平均约为400 μmol·L−1.高尔基器钙库分3部分:顺式高尔基器钙离子浓度平均约为250 μmol·L−1,表达SERCA、IP3R;中间高尔基器表达SERCA、 SPCA1,不表达IP3R;反式高尔基器表达SPCA1、RyR,但是不表达IP3R,腔面Ca2+浓度约为130 μmol·L−1.分泌囊泡(SV)包被膜表达SPCA1、RyR,腔面Ca2+浓度约为80 μmol·L−1.图中IP3R为 三磷酸肌醇受体;RyR为利阿诺定受体;TGN为反式高尔基器网络;SV为分泌囊泡.高尔基器钙库的作用,在其他细胞如心肌细胞也发挥关键作用.研究发现在心肌细胞,高尔基器的钙释放与其功能调节相偶联,包括对囊泡转运的调控。心肌细胞的高尔基器,是其胞内持续性Ca2+浓度升高的源头,发源于心肌细胞的近核区域.高尔基器钙释放不受肌质网钙耗竭的影响,破坏高尔基器后其钙库钙释放消失,但不影响肌浆网钙释放,揭示肌浆网钙库和高尔基器钙库在空间和功能上的相互独立[12].刺激心肌细胞β1肾上腺素能受体,触发胞浆cAMP的产生,继而激活腺苷酸交换因子Epac 和蛋白激酶A.磷酸二酯酶(phosphodiesterase, PDE),如PDE3和PDE4,可以降解胞浆cAMP[12].心肌细胞β1肾上腺素能受体被激活后刺激高尔基器钙释放,这一过程需要Epac、PKA和激酶CaMKII的参与 [12].对PDE3和PDE4的抑制,可增强β1受体所诱导的高尔基器钙释放,说明近高尔基器cAMP信号的区域化.刺激高尔基器钙释放,可增加血管内皮细胞生长因子受体(vascular endothelial growth factor receptor-1, VEGFR-1)从高尔基器向心肌细胞表面质膜的转运[12].心衰大鼠心肌细胞的PDE3,4丰度降低,导致相应的高尔基器钙释放事件的增加.这些数据说明高尔基器是β1受体介导钙信号的特定位点,高尔基器钙库功能独立于肌浆网和全细胞钙瞬变所触发的心肌细胞收缩[12].
高尔基器通过肌浆/内质网钙泵(sarco-endoplasmic reticulum Ca2+ ATPase, SERCA)和分泌通路钙泵(secretory pathway Ca2+ ATPase1, SPCA1)摄取钙.高尔基器钙库可通过IP3R的激活释放Ca2+.将一个以荧光共振能量转移(fluorescence resonance energy transfer, FRET)原理为基础的Ca2+指示探针特异性在反式高尔基器表达,发现反式高尔基器对IP3刺激不敏感,只通过SPCA1摄取Ca2+[13].而SERCA和IP3R只在顺式和中间高尔基器表达[13].通过小干扰RNA (small interfering RNA, RNAi)的方法将SPCA1表达降低,可降低反式高尔基器腔面的Ca2+浓度,导致分泌通路蛋白质转运的重大变化以及高尔基器形态的崩溃[13].这些工作说明SPCA1在高尔基器的结构与功能中发挥重要作用.
2 高尔基器的分泌通路钙泵
在多种细胞类型中,除了SERCA和质膜钙泵PMCA之外,在高尔基器/分泌通路,尚存在高尔基器/分泌通路钙泵(SPCA).
事实上人类基因组有2个spca基因,编码SPCA1和SPCA2共2个同工ATP水解酶.研究发现SPCA1和2的N端和C端与质膜ORAI1偶联,介导Ca2+的非钙库依赖性(非STIM1依赖性)的钙内流(store-independent Ca2+ entry, SICE) [14−15].近期逐渐增加的遗传学和在体实验证据说明,SPCA同工酶的功能障碍与多种人类疾病相关[16].
SPCA1/2将Ca2+和Mn2+转运进入高尔基器和分泌通路.SPCA2通过非STIM1依赖的ORAI 激活,介导非钙库依赖的SICE,从而在泌乳期的乳腺上皮细胞,诱导组成性或固有性SICE[15].与SPCA2类似,SPCA1的过表达诱导非STIM1依赖,而是ORAI1依赖的SICE.这一过程导致胞浆钙以及非ER钙库钙浓度的升高,揭示Orai1和SPCA1之间的功能偶联[15].研究发现Orai1和SPCA1a这2种蛋白质在质膜共定位.
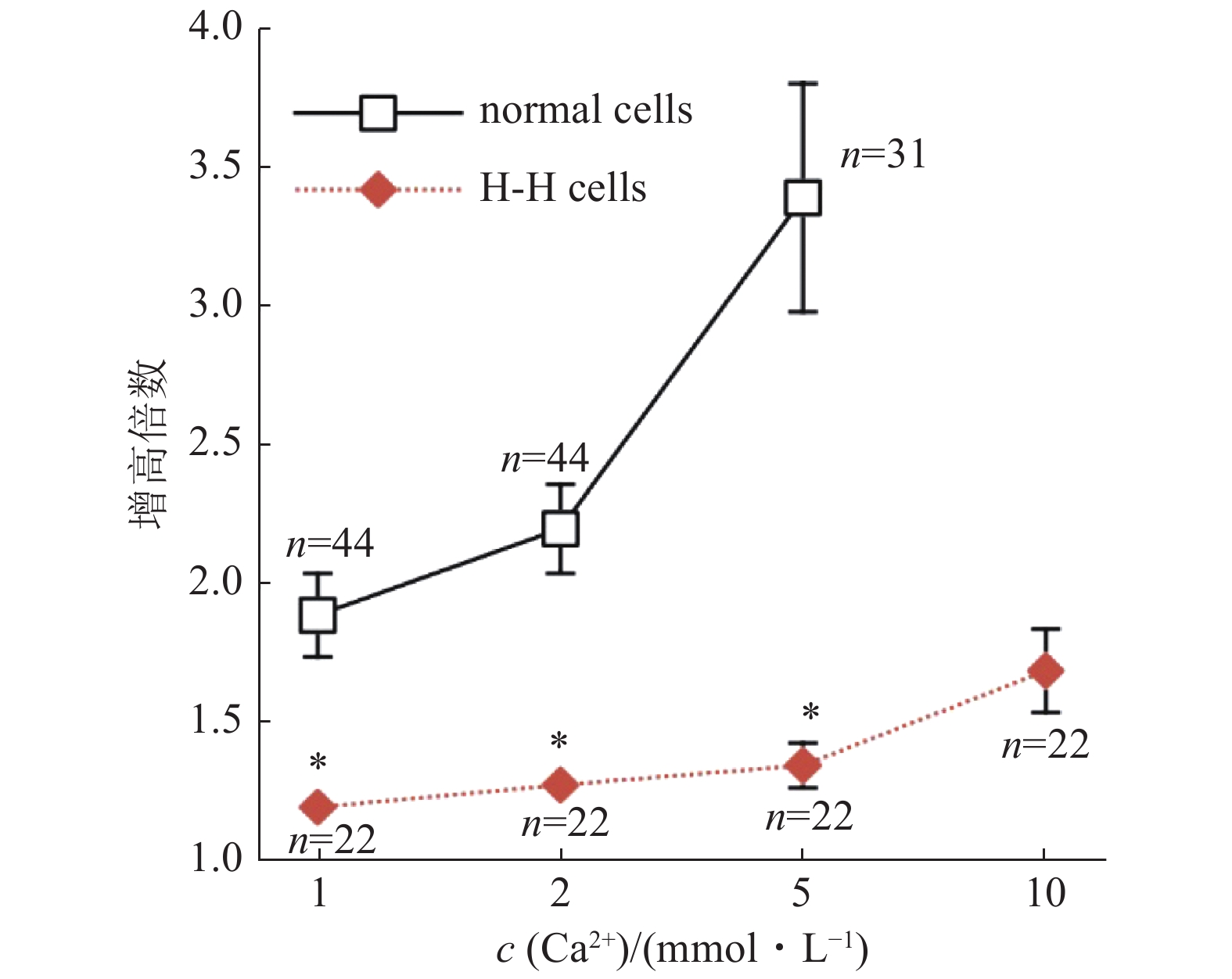
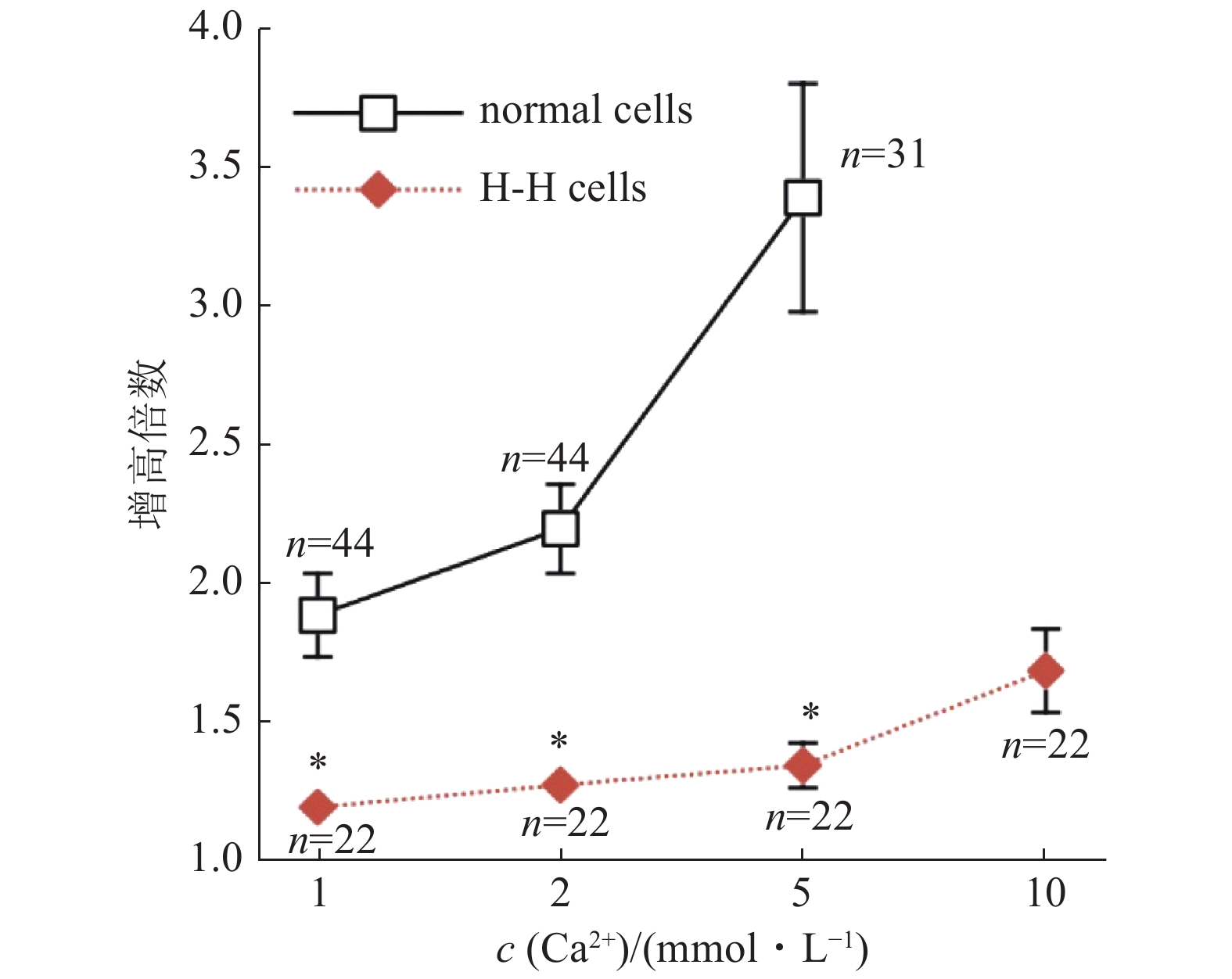
已知常染色体显性的Hailey-Hailey病(Hailey-Hailey disease, HHD)表现为持续性皮肤起泡和糜烂.研究发现HHD病人的高尔基器钙泵发生多点突变,导致胞浆钙稳态的失衡.与健康人相比,培养的HHD病人皮肤角质化细胞的胞浆钙调节失调,基础Ca2+浓度显著降低[17],如图3所示.
![]() 图 3 正常人和HHD病人皮肤角质化细胞胞浆Ca2+浓度随胞外液Ca2+浓度升高而发生不同变化[17]图中横轴显示胞外液的Ca2+浓度;纵轴显示胞浆Ca2+浓度与基础Ca2+浓度相比升高的倍数.黑色方块符号为正常细胞;红色菱形符号为H-H病人细胞.星号指示统计学差异显著,*P < 0.005.
图 3 正常人和HHD病人皮肤角质化细胞胞浆Ca2+浓度随胞外液Ca2+浓度升高而发生不同变化[17]图中横轴显示胞外液的Ca2+浓度;纵轴显示胞浆Ca2+浓度与基础Ca2+浓度相比升高的倍数.黑色方块符号为正常细胞;红色菱形符号为H-H病人细胞.星号指示统计学差异显著,*P < 0.005.SPCA1的功能丢失性突变所导致的SPCA1a/Orai1偶联障碍,可能与皮肤病变Hailey-Hailey 病(HHD)有关[15].HHD相关联的SPCA1a突变,导致 Ca2+转运和/或Orai1激活障碍 ,影响非ER钙库的Ca2+浓度.故SPCA1 和 Orai1的功能偶联,增加胞浆和钙库腔面Ca2+水平,这是非钙库依赖SICE的一种新机制,这一机制在HHD病中受到影响[15].
SPCA2蛋白质的N-和C-端的两端延长部分具有双重作用,即激活ORAI1,而且激活Ca2+向Golgi/分泌通路的转运,这可以通过检测将SPCA2蛋白的N-、C-端截短后对SICE和Ca2+ 转运的影响来验证[18].C-端截短减少SICE和SPCA2活性,同时影响其定位;而N-端截短影响其定位,并导致SPCA2的失活,但是SICE 不受影响.过表达SPCA2 增加非ER钙库的钙容量,钙库钙容量依赖于Orai1和SPCA2 的活性[18].Orai1介导的SICE和SPCA2介导的Golgi/分泌通路钙摄取,应该在同一个亚细胞微区偶联.这一钙通道/钙泵复合体可以将Ca2+ 有效转移至分泌通路,从而调控SPCA2表达分泌细胞[18].
抑制SPCA2的表达后,降低基础Ca2+浓度和肿瘤发生.与其在高尔基器中滞留Ca2+不同,SPCA2的表达增加外Ca2+内流,这一过程依赖于钙库操纵的Ca2+通道Orai1.SPCA2-Orai1信号不依赖于内质网Ca2+ 库或其Ca2+感应蛋白STIM1、STIM2,与SPCA2的Ca2+- ATPase水解酶活性无关[14].
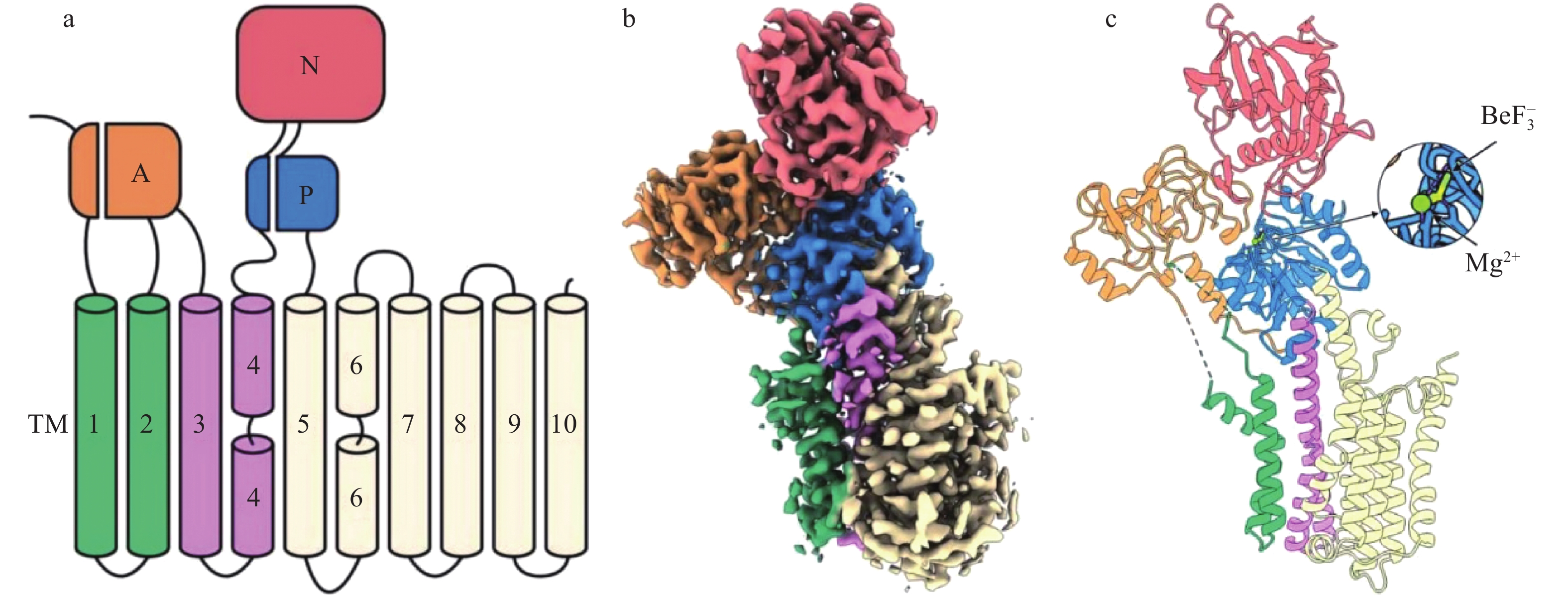
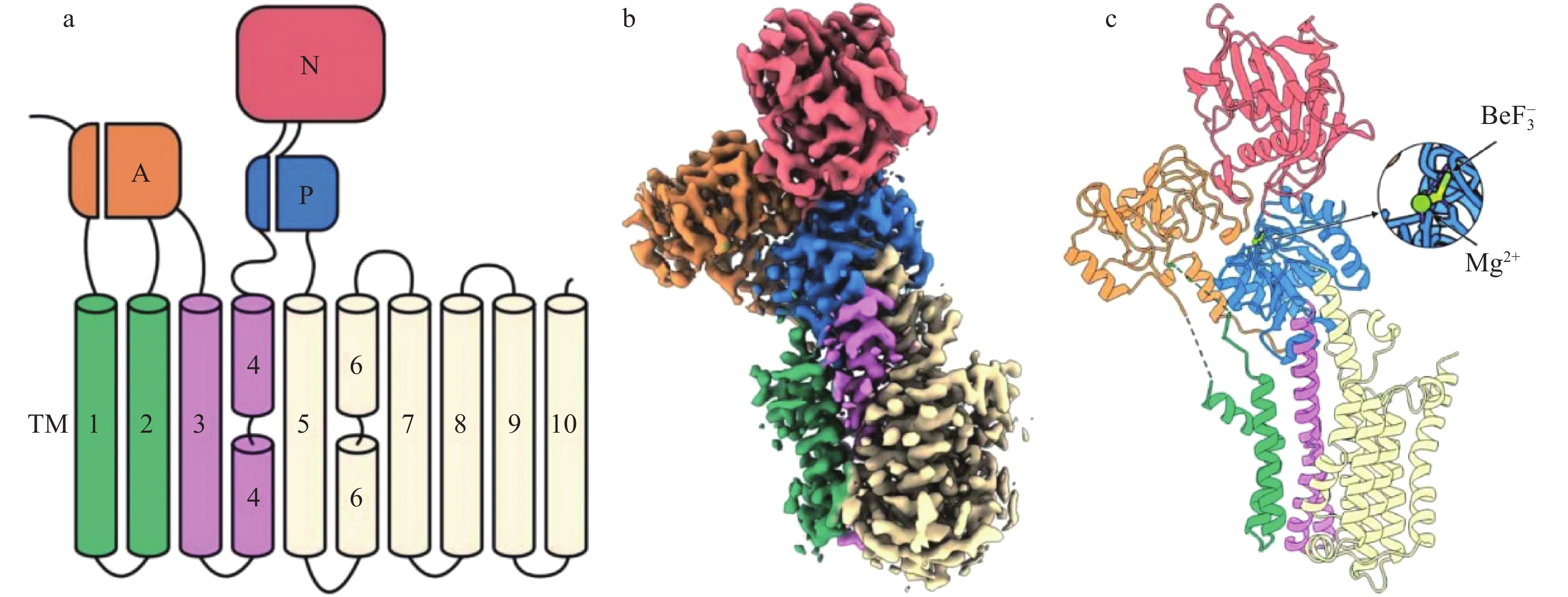
SPCA1将胞浆Ca2+ / Mn2+主动转运进入高尔基器腔,在细胞钙和锰稳态发挥关键作用.冷冻电镜解析了人源hSPCA1a的ATP和 Ca2+/Mn2+-结合态(E1- ATP),以及无二价阳离子结合的磷酸化态(E2P) 的0.31~0.33 nm分辨率结构 (图4)[19].结构显示Ca2+和Mn2+分享同一个金属离子结合口袋,但是其在跨膜结构域的空间配位键不同,这一结合口袋与SERCA的第2个Ca2+结合位点相对应.当E1-ATP构象向E2P构象转换时,SPCA1a的结合域重组过程,与SERCA非常类似.SPCA1a 的空间结构显示,TM2和TM6具有更大的空间和位置灵活性,可能揭示其更宽泛的阳离子选择性 (图4)[19].
![]() 图 4 分泌通路钙泵SPCA1a的质膜拓扑结构和冷冻电镜E2P态电子密度图和三维条带示意[19]a. SPCA1a的不同结构域.SPCA1a含有3个胞浆面结构域:A-结构域 (橙色), P-结构域 (蓝)和N-结构域 (粉红色),以及跨膜结构域TM1~2、TM3~4和TM5~10 (分别为绿色、紫色、淡黄色).b. SPCA1a的E2-BeF3状态的冷冻电镜电子密度.c. SPCA1a冷冻电镜结构的E2-BeF3状态条带示意.胞浆结构域A、P、N,跨膜结构域TM1~2、TM3~4和TM5~10的颜色编码与a、b相同.SPCA1a的配体(${\rm{BeF}}_3^- $、Mn2+)结合部位被放大.
图 4 分泌通路钙泵SPCA1a的质膜拓扑结构和冷冻电镜E2P态电子密度图和三维条带示意[19]a. SPCA1a的不同结构域.SPCA1a含有3个胞浆面结构域:A-结构域 (橙色), P-结构域 (蓝)和N-结构域 (粉红色),以及跨膜结构域TM1~2、TM3~4和TM5~10 (分别为绿色、紫色、淡黄色).b. SPCA1a的E2-BeF3状态的冷冻电镜电子密度.c. SPCA1a冷冻电镜结构的E2-BeF3状态条带示意.胞浆结构域A、P、N,跨膜结构域TM1~2、TM3~4和TM5~10的颜色编码与a、b相同.SPCA1a的配体(${\rm{BeF}}_3^- $、Mn2+)结合部位被放大.高尔基器中的Ca2+可以至少与Cab45、P54/NEFA和CALNUC (nucleobindin) [6,20-21]3种钙结合蛋白相结合.
储存于高尔基器钙库,被Ca2+结合蛋白所螯合的Ca2+,在高尔基器被激活后,通过特定Ca2+通透性通道,释放进入胞浆.这些Ca2+通透的离子通道,包括高尔基器所表达的抗凋亡蛋白(Golgi anti-apoptotic protein, GAAP).
3 高尔基器的钙释放通道
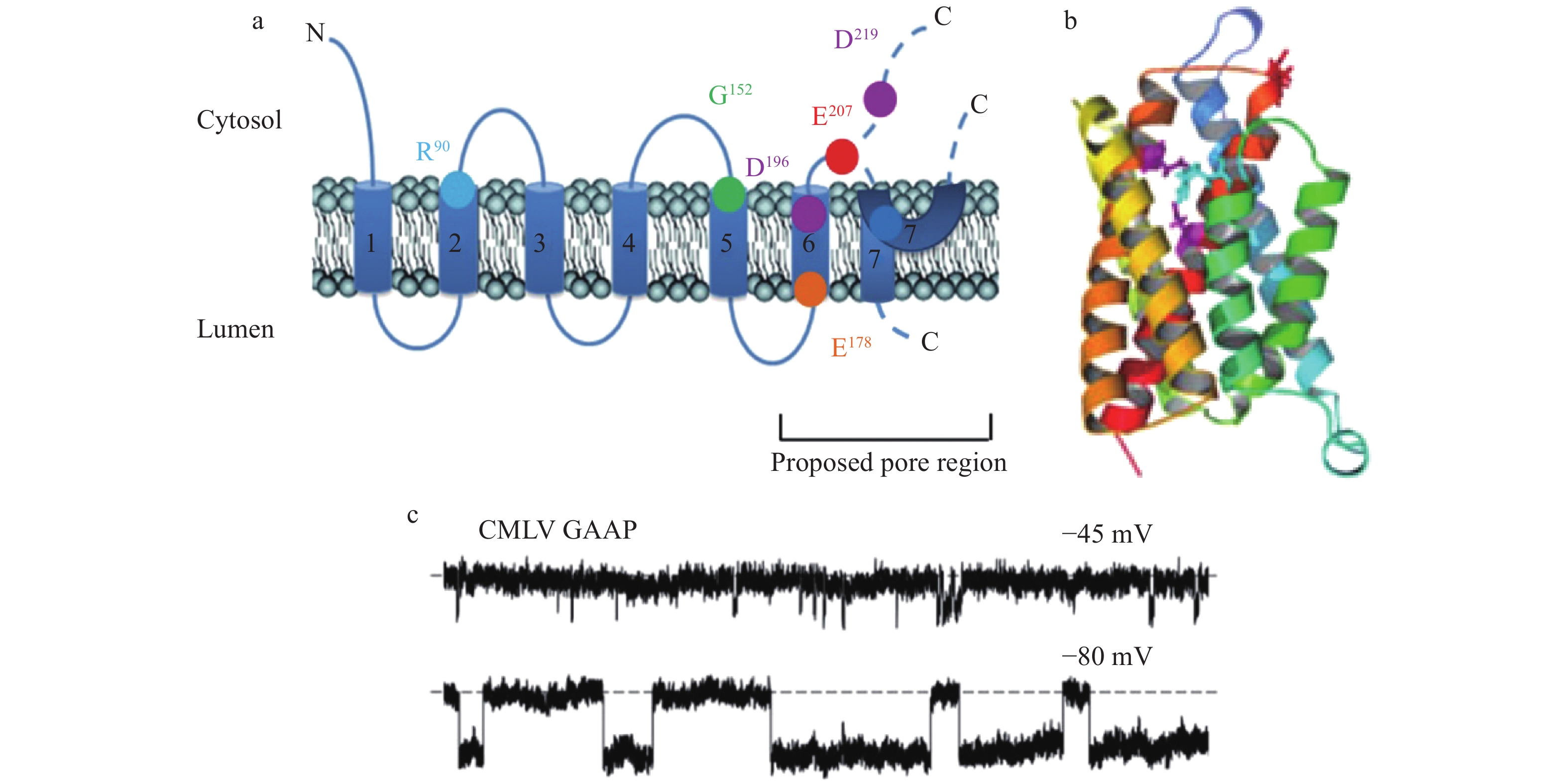
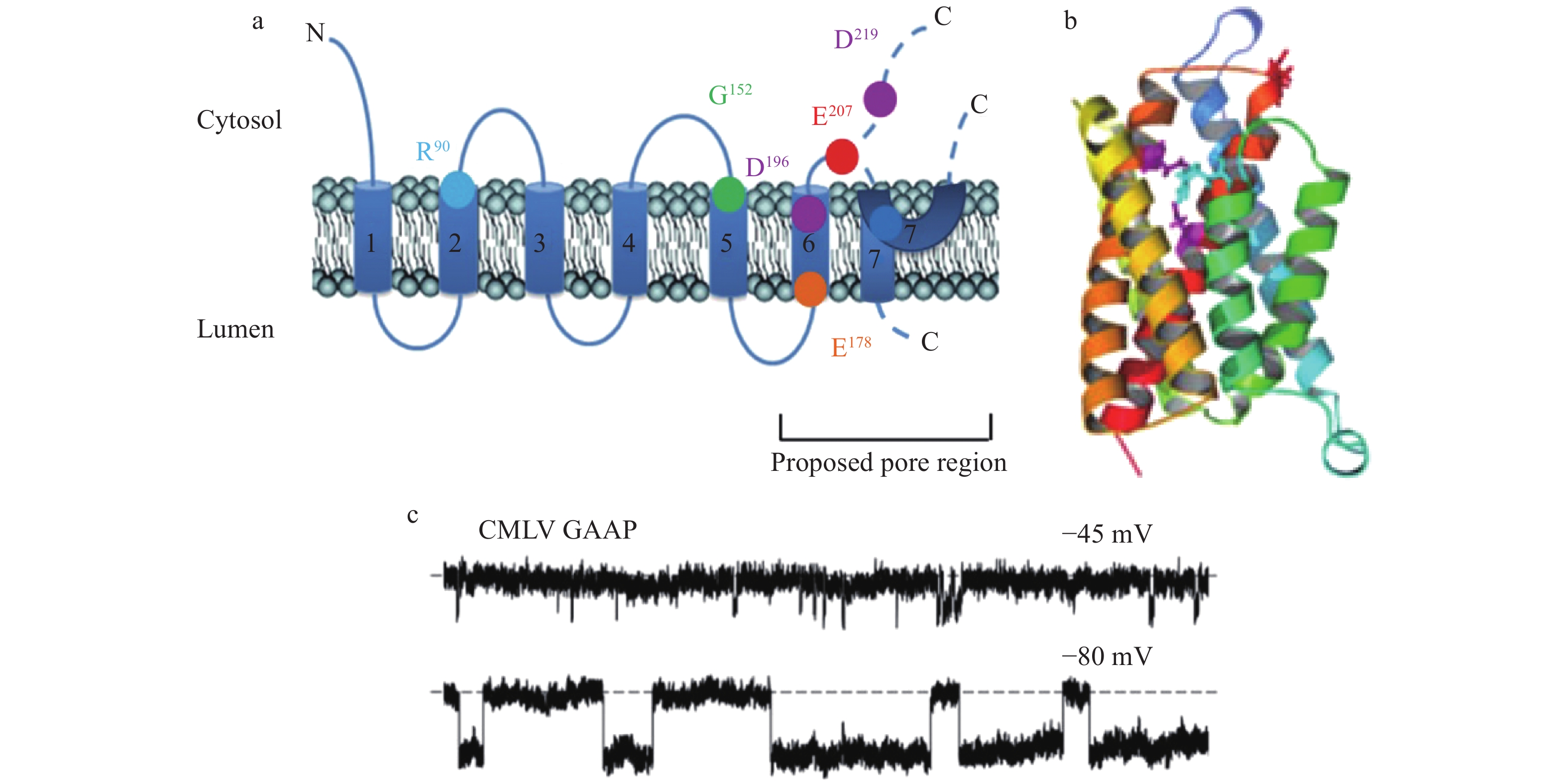
GAAP是在高尔基器表达的多次跨膜蛋白,又称跨膜Bax抑制剂-1基序4 (transmembrane Bax inhibitor-1 motif-containing 4, TMBIM4),或称Lifeguard 4 (Lfg4).这种蛋白质在真核生物高度保守,在低等原核生物和正痘病毒也正常表达[22].真核生物的GAAP调节胞内钙库的钙容量.纯化的驼痘病毒GAAP (vGAAP),以及类似同工蛋白如人源Bax抑制因子1,在人工脂双层膜上,均可形成自发开放的电压门控阳离子通道(图5) [22].对vGAAP的定点突变,可改变通道的电导(E207Q, D219N)和离子选择性(E207Q) [22].说明GAAP是离子通道蛋白,而且残基Glu(E)207、Asp(D)219参与组成通道的离子传导孔道(图5)[22].
![]() 图 5 驼痘病毒vGAAP的质膜拓扑结构和三维空间结构[22]a. 驼痘病毒vGAAP蛋白的质膜拓扑结构,包括跨膜结构域1~7 (TMD1~7).残基Glu207、Asp219为通道电导所必需,Glu207与通道离子选择性有关;2个残基皆位于通道孔壁.残基Asp219是抑制凋亡作用所必需,Glu207对于细胞黏附和迁移作用比较重要.Arg90、Asp196、Asp219形成通道的关闭锁.b. 以BsYetJ晶体结构为模板使用软件I-TASSER所产生的驼痘病毒vGAAP通道处于关闭状态的同源三维结构模型.残基侧链着色为紫红色(Asp196、Asp219)、红色(Glu207)和蓝色 (Arg90).跨膜序列从C端到N端按照赤橙黄绿青蓝紫的顺序逐渐演变为TMD1 (深蓝)、TMD2 (浅蓝)、TMD3 (绿色)、TMD4 (黄色)、TMD5 (浅橙色)、TMD6 (深橙色)和TMD7 (红色).c. 驼痘病毒(CMLV) vGAAP通道的单通道记录.将vGAAP在人工双脂层重组,在不同的钳制电压(−45 mV, −80 mV)下可见到通道的自发开放.记录痕迹中的水平虚线,显示通道关闭状态.
图 5 驼痘病毒vGAAP的质膜拓扑结构和三维空间结构[22]a. 驼痘病毒vGAAP蛋白的质膜拓扑结构,包括跨膜结构域1~7 (TMD1~7).残基Glu207、Asp219为通道电导所必需,Glu207与通道离子选择性有关;2个残基皆位于通道孔壁.残基Asp219是抑制凋亡作用所必需,Glu207对于细胞黏附和迁移作用比较重要.Arg90、Asp196、Asp219形成通道的关闭锁.b. 以BsYetJ晶体结构为模板使用软件I-TASSER所产生的驼痘病毒vGAAP通道处于关闭状态的同源三维结构模型.残基侧链着色为紫红色(Asp196、Asp219)、红色(Glu207)和蓝色 (Arg90).跨膜序列从C端到N端按照赤橙黄绿青蓝紫的顺序逐渐演变为TMD1 (深蓝)、TMD2 (浅蓝)、TMD3 (绿色)、TMD4 (黄色)、TMD5 (浅橙色)、TMD6 (深橙色)和TMD7 (红色).c. 驼痘病毒(CMLV) vGAAP通道的单通道记录.将vGAAP在人工双脂层重组,在不同的钳制电压(−45 mV, −80 mV)下可见到通道的自发开放.记录痕迹中的水平虚线,显示通道关闭状态.GAAP (TMBIM4)在高尔基器跨膜寡聚化后,形成Ca2+通道 [23].关于哺乳动物GAAP通道的通道特性以及生理性内在门控机制,目前所知甚少.已知人源、病毒源GAAP以及细菌同工蛋白如BsYetJ的同寡聚化,均受到pH的调控[22, 24].4种不同的同工蛋白TMBIM1~4都在高尔基器高表达[24].可以借鉴的是,文献报道溶酶体跨膜钙通道TMBIM1受pH的调控[25],而ER跨膜钙通道TMBIM6受ER脂肪环境的调节[26].
GAAP不像IP3R、RyR,可以分别被IP3和咖啡因所激活,目前尚未发现GAAP钙通道的内源性激动剂.
尽管如此,研究发现吐根碱(emetine)可以特异性刺激高尔基器钙库的钙释放.在Hela细胞和心房肌细胞HL-1,提取自吐根树的抗原虫和催吐药吐根碱,特异性从高尔基器钙库释放Ca2+[27].顺式高尔基器需要持续性从胞外或ER获得Ca2+,以获得足够多的钙源将之释放至胞浆.吐根碱敏感的钙动员机制与2种经典的钙动员机制(IP3R和RyR)完全不同[27].吐根碱特异性从高尔基器释放Ca2+,并不是因为吐根碱抑制了分泌通路钙泵活性,而可能是因为激活了Ca2+通透离子通道;这是否与GAAP有关,有待进一步研究[27].吐根碱对高尔基器钙库的钙释放作用,可以解释为何长期服用吐根糖浆会产生肌肉副作用[27].
人源GAAP (TMBIM4)不但调节高尔基器钙库钙信号,也是细胞存活和抗凋亡所必需,同时促进细胞黏附和迁移.对驼痘病毒vGAAP的定点突变实验显示,残基Glu207或 Glu178的突变,降低 vGAAP的细胞迁移和细胞黏附调控作用,但是对其抗凋亡作用没有影响[22].残基Asp219的突变消除GAAP的抗凋亡活性,但是对其细胞迁移和黏附作用没有影响(图5)[22].研究发现,过表达人源hGAAP可刺激细胞的三维蛋白水解类细胞浸润,这一过程是由活性氧所介导的,因为过表达hGAAP刺激线粒体呼吸[28].
4 结论与展望
从早期基于Ca2+荧光指示剂的共聚焦成像研究,到亚细胞定位的基因编码的低亲和力荧光蛋白质Ca2+指示剂的应用,以及对高尔基器钙库特异性表达的SPCA,高尔基器钙库特异性表达的Ca2+通透性阳离子通道GAAP的阐述,关于高尔基器钙库功能的阐述逐渐清晰起来.
作为在蛋白质分泌通路上的关键一环,高尔基器钙库与ER钙库、分泌囊泡钙库,在Ca2+处理相关功能蛋白元件的表达上,有明显区别.高尔基器作为蛋白质转运的中转站,各种功能蛋白如细胞质膜表达的G蛋白偶联受体,在高尔基器钙库中发生的变化和成熟过程,并不十分清楚.我们实验室最近发现的亚细胞定位G蛋白偶联受体光动力永久性激活[29],可能有助于解决高尔基器中G蛋白偶联受体成熟中的一些问题.全面了解高尔基器中其他跨膜蛋白对高尔基器钙库功能的影响,具有十分重要的意义.如已有研究发现:在血管平滑肌细胞,囊泡型氯离子转运蛋白ClC-6 特异性定位高表达于高尔基器;高尔基器ClC-6表达的降低,导致高尔基器钙库容量的减少[30].在不同类型的细胞,高尔基器的功能可能略有不同.比如在本文开始所提到的成纤维细胞,高尔基器位于细胞核周,但是在典型的极化分泌上皮,如胰腺腺泡细胞,高尔基器则位于细胞中部所谓的线粒体环的顶端侧、酶原颗粒的基底侧(内质网富集区和酶原颗粒区之间),且与细胞核尚有一段的空间距离[31].
从薛绍白教授开始,北京师范大学生物学学科关于钙信号及其功能的研究,正在继续.现任教学科研人员在钙信号的不同方面,也都作出了各有特色的研究成果.
-
图 1 高尔基器钙库的早期形态学证据[2]
游离钙离子与高尔基器在2BS细胞的亚细胞共定位,说明核周高钙区域与高尔基器区域重合。a. 一个2BS细胞的Fluo-3荧光亚细胞分布;b. C6-NBD-神经酰胺在同一个2BS细胞的亚细胞荧光分布.注意a、b图中荧光亚细胞分布的相似性.c. PDGF刺激一个加载了Fluo-3荧光探针的2BS细胞,细胞不同区域的Fluo-3荧光强度随时间的变化.绿、红、黄、蓝色曲线分别代表在同一个2BS细胞中,高尔基器、细胞核以及选定的2处不同的胞浆区域的钙离子浓度变化,白色箭头显示PDGF刺激的开始.d. 是c的时间轴扩展放大,注意高尔基器钙离子浓度(绿色)降低的同时,细胞核钙离子浓度(红色)反向升高.
图 2 胞内钙库腔面Ca2+浓度的梯度分布[9]
ER和高尔基器钙库腔面实测Ca2+浓度来自HeLa细胞,分泌囊泡腔面钙浓度数据来自胰岛素分泌细胞.不同钙库之中,钙稳态相关功能蛋白质的分布不同.ER表达有SERCA、IP3R、RyR,腔面Ca2+浓度平均约为400 μmol·L−1.高尔基器钙库分3部分:顺式高尔基器钙离子浓度平均约为250 μmol·L−1,表达SERCA、IP3R;中间高尔基器表达SERCA、 SPCA1,不表达IP3R;反式高尔基器表达SPCA1、RyR,但是不表达IP3R,腔面Ca2+浓度约为130 μmol·L−1.分泌囊泡(SV)包被膜表达SPCA1、RyR,腔面Ca2+浓度约为80 μmol·L−1.图中IP3R为 三磷酸肌醇受体;RyR为利阿诺定受体;TGN为反式高尔基器网络;SV为分泌囊泡.
图 3 正常人和HHD病人皮肤角质化细胞胞浆Ca2+浓度随胞外液Ca2+浓度升高而发生不同变化[17]
图中横轴显示胞外液的Ca2+浓度;纵轴显示胞浆Ca2+浓度与基础Ca2+浓度相比升高的倍数.黑色方块符号为正常细胞;红色菱形符号为H-H病人细胞.星号指示统计学差异显著,*P < 0.005.
图 4 分泌通路钙泵SPCA1a的质膜拓扑结构和冷冻电镜E2P态电子密度图和三维条带示意[19]
a. SPCA1a的不同结构域.SPCA1a含有3个胞浆面结构域:A-结构域 (橙色), P-结构域 (蓝)和N-结构域 (粉红色),以及跨膜结构域TM1~2、TM3~4和TM5~10 (分别为绿色、紫色、淡黄色).b. SPCA1a的E2-BeF3状态的冷冻电镜电子密度.c. SPCA1a冷冻电镜结构的E2-BeF3状态条带示意.胞浆结构域A、P、N,跨膜结构域TM1~2、TM3~4和TM5~10的颜色编码与a、b相同.SPCA1a的配体(${\rm{BeF}}_3^- $、Mn2+)结合部位被放大.
图 5 驼痘病毒vGAAP的质膜拓扑结构和三维空间结构[22]
a. 驼痘病毒vGAAP蛋白的质膜拓扑结构,包括跨膜结构域1~7 (TMD1~7).残基Glu207、Asp219为通道电导所必需,Glu207与通道离子选择性有关;2个残基皆位于通道孔壁.残基Asp219是抑制凋亡作用所必需,Glu207对于细胞黏附和迁移作用比较重要.Arg90、Asp196、Asp219形成通道的关闭锁.b. 以BsYetJ晶体结构为模板使用软件I-TASSER所产生的驼痘病毒vGAAP通道处于关闭状态的同源三维结构模型.残基侧链着色为紫红色(Asp196、Asp219)、红色(Glu207)和蓝色 (Arg90).跨膜序列从C端到N端按照赤橙黄绿青蓝紫的顺序逐渐演变为TMD1 (深蓝)、TMD2 (浅蓝)、TMD3 (绿色)、TMD4 (黄色)、TMD5 (浅橙色)、TMD6 (深橙色)和TMD7 (红色).c. 驼痘病毒(CMLV) vGAAP通道的单通道记录.将vGAAP在人工双脂层重组,在不同的钳制电压(−45 mV, −80 mV)下可见到通道的自发开放.记录痕迹中的水平虚线,显示通道关闭状态.
-
[1] XUE S B,NICOUD M R,CUI J,et al. High concentration of calciun ions in Golgi apparatus[J]. Cell Research, 1994, 4(1):97
[2] CUI J,LI Y,XUE S B. Visualization of Golgi apparatus as an intracellular calcium store by laser scanning confocal microscope[J]. Cell Research, 1995, 5(2): 165
[3] ZHA X,CHANDRA S,RIDSDALE A J,et al. Golgi apparatus is involved in intracellular Ca2+ regulation in epithelial LLC-PK1 cells[J]. American Journal of Physiology-Cell Physiology,1995,268(5):C1133 doi: 10.1152/ajpcell.1995.268.5.C1133
[4] PINTON P,POZZAN T,RIZZUTO R. The Golgi apparatus is an inositol 1,4,5-trisphosphate-sensitive Ca2+ store,with functional properties distinct from those of the endoplasmic reticulum[J]. The EMBO Journal,1998,17(18):5298 doi: 10.1093/emboj/17.18.5298
[5] MISETA A,FU L,KELLERMAYER R,et al. The Golgi apparatus plays a significant role in the maintenance of Ca2+ homeostasis in the vps33Delta vacuolar biogenesis mutant of Saccharomyces cerevisiae [J]. The Journal of Biological Chemistry,1999,274(9):5939 doi: 10.1074/jbc.274.9.5939
[6] LIN P,YAO Y,HOFMEISTER R,et al. Overexpression of CALNUC (nucleobindin) increases agonist and thapsigargin releasable Ca2+ storage in the Golgi[J]. The Journal of Cell Biology,1999,145(2):279 doi: 10.1083/jcb.145.2.279
[7] WU J H,PROLE D,SHEN Y,et al. Red fluorescent genetically encoded Ca2+ indicators for use in mitochondria and endoplasmic reticulum[J]. Biochemical Journal,2014,464(1):13 doi: 10.1042/BJ20140931
[8] KONIECZNY V,TOVEY S C,MATARAGKA S,et al. Cyclic AMP recruits a discrete intracellular Ca2+ store by unmasking hypersensitive IP3 receptors[J]. Cell Reports,2017,18(3):711 doi: 10.1016/j.celrep.2016.12.058
[9] PIZZO P,LISSANDRON V,CAPITANIO P,et al. Ca2+ signalling in the Golgi apparatus[J]. Cell Calcium,2011,50(2):184 doi: 10.1016/j.ceca.2011.01.006
[10] WONG A K C,CAPITANIO P,LISSANDRON V,et al. Heterogeneity of Ca2+ handling among and within Golgi compartments[J]. Journal of Molecular Cell Biology,2013,5(4):266 doi: 10.1093/jmcb/mjt024
[11] AULESTIA F,ALONSO M,GARCÍA-SANCHO J. Differential calcium handling by the cis and trans regions of the Golgi apparatus[J]. Biochemical Journal,2015,466(3):455 doi: 10.1042/BJ20141358
[12] YANG Z K,KIRTON H M,MACDOUGALL D A,et al. The Golgi apparatus is a functionally distinct Ca2+ store regulated by the PKA and Epac branches of the β1-adrenergic signaling pathway[J]. Science Signaling,2015,8(398):eaaa7677
[13] PIZZO P,LISSANDRON V,POZZAN T. The trans-Golgi compartment[J]. Communicative & Integrative Biology,2010,3(5):462
[14] FENG M Y,GRICE D M,FADDY H M,et al. Store-independent activation of Orai1 by SPCA2 in mammary tumors[J]. Cell,2010,143(1):84 doi: 10.1016/j.cell.2010.08.040
[15] SMAARDIJK S,CHEN J L,KERSELAERS S,et al. Store-independent coupling between the secretory pathway Ca2+ transport ATPase SPCA1 and Orai1 in Golgi stress and Hailey-Hailey disease[J]. Biochimica et Biophysica Acta (BBA): Molecular Cell Research,2018,1865(6):855 doi: 10.1016/j.bbamcr.2018.03.007
[16] CHEN J L,SITSEL A,BENOY V,et al. Primary active Ca2+ transport systems in health and disease[J]. Cold Spring Harbor Perspectives in Biology,2020,12(2):a035113 doi: 10.1101/cshperspect.a035113
[17] HU Z L,BONIFAS J M,BEECH J,et al. Mutations in ATP2C1,encoding a calcium pump,cause Hailey-Hailey disease[J]. Nature Genetics,2000,24(1):61 doi: 10.1038/71701
[18] SMAARDIJK S,CHEN J L,WUYTACK F,et al. SPCA2 couples Ca2+ influx via Orai1 to Ca2+ uptake into the Golgi/secretory pathway[J]. Tissue and Cell,2017,49(2):141 doi: 10.1016/j.tice.2016.09.004
[19] CHEN Z H,WATANABE S,HASHIDA H,et al. Cryo-EM structures of human SPCA1a reveal the mechanism of Ca2+/Mn2+ transport into the Golgi apparatus[J]. Science Advances,2023,9(9):eadd9742 doi: 10.1126/sciadv.add9742
[20] GILON P,CHAE H Y,RUTTER G A,et al. Calcium signaling in pancreatic β-cells in health and in Type 2 diabetes[J]. Cell Calcium,2014,56(5):340 doi: 10.1016/j.ceca.2014.09.001
[21] PRINS D,MICHALAK M. Organellar calcium buffers[J]. Cold Spring Harbor Perspectives in Biology,2011,3(3):a004069
[22] CARRARA G,SARAIVA N,PARSONS M,et al. Golgi anti-apoptotic proteins are highly conserved ion channels that affect apoptosis and cell migration[J]. Journal of Biological Chemistry,2015,290(18):11785 doi: 10.1074/jbc.M115.637306
[23] CARRARA G,PARSONS M,SARAIVA N,et al. Golgi anti-apoptotic protein:a tale of camels,calcium,channels and cancer[J]. Open Biology,2017,7(5):170045 doi: 10.1098/rsob.170045
[24] ZHANG L,BUHR S,VOIGT A,et al. The evolutionary conserved transmembrane BAX inhibitor motif (TMBIM) containing protein family members 5 and 6 are essential for the development and survival of drosophila melanogaster[J]. Frontiers in Cell and Developmental Biology,2021,9:666484 doi: 10.3389/fcell.2021.666484
[25] PIHÁN P,LISBONA F,BORGONOVO J,et al. Control of lysosomal-mediated cell death by the pH-dependent calcium channel RECS1[J]. Science Advances, 2021,7:eabe5469 doi: 10.1126/sciadv.abe5469
[26] LAN Y J,CHENG C C,CHU S C,et al. A gating mechanism of the BsYetJ calcium channel revealed in an endoplasmic reticulum lipid environment[J]. Biochimica et Biophysica Acta (BBA): Biomembranes,2023,1865(5):184153 doi: 10.1016/j.bbamem.2023.184153
[27] GALLEGOS-GÓMEZ M L,GREOTTI E,LÓPEZ-MÉNDEZ M C,et al. The trans Golgi region is a labile intracellular Ca2+ store sensitive to emetine[J]. Scientific Reports,2018,8:17143 doi: 10.1038/s41598-018-35280-z
[28] ALMEIDA N,CARRARA G,PALMEIRA C M,et al. Stimulation of cell invasion by the Golgi ion channel GAAP/TMBIM4 via an H2O2-dependent mechanism[J]. Redox Biology,2020,28:101361 doi: 10.1016/j.redox.2019.101361
[29] LI Y,CUI Z J. Photodynamic activation of cholecystokinin 1 receptor with different genetically encoded protein photosensitizers and from varied subcellular sites[J]. Biomolecules,2020,10(10):1423 doi: 10.3390/biom10101423
[30] KLEMENS C A,CHULKOV E G,WU J,et al. Loss of chloride channel 6 (CLC-6) affects vascular smooth muscle contractility and arterial stiffness via alterations to Golgi calcium stores[J]. Hypertension,2021,77(2):582 doi: 10.1161/HYPERTENSIONAHA.120.16589
[31] DOLMAN N J,GERASIMENKO J V,GERASIMENKO O V,et al. Stable golgi-mitochondria complexes and formation of Golgi Ca2+ gradients in pancreatic acinar cells[J]. Journal of Biological Chemistry,2005,280(16):15794 doi: 10.1074/jbc.M412694200
-
期刊类型引用(1)
1. Zong Jie Cui. The Golgi Ca~(2+) stores, and original contributions by Prof. Shao Bai Xue. Biophysics Reports. 2024(05): 266-273 .  必应学术
必应学术
其他类型引用(0)




 下载:
下载: